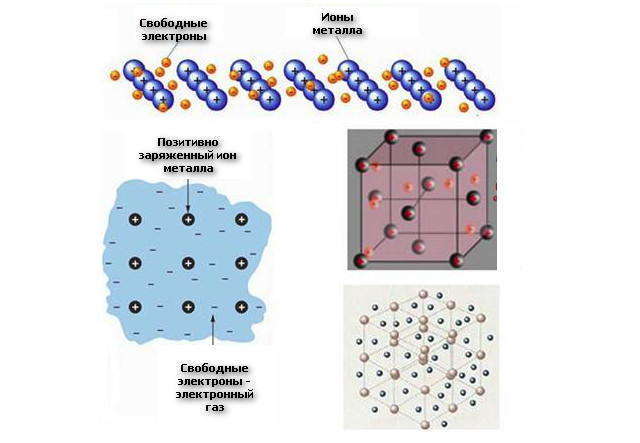
Металлической называется многоцентровая связь, которая существует в металлах и их сплавах между положительно заряженными ионами и валентными электронами, которые являются общими для всех ионов и свободно передвигаются по кристаллу.
Атомы металлов имеют небольшое количество валентных электронов и низкую энергию ионизации. Эти электроны вследствие больших радиусов атомов металлов достаточно слабо связаны со своими ядрами и могут легко отрываться от них и становиться общими для всего кристалла металла. В результате в кристаллической решетке металла возникают положительно заряженные ионы металла и электронный газ — совокупность подвижных электронов, которые свободно передвигаются по кристаллу металла .
В результате металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, которые сравнительно свободно передвигаются в поле положительных центров. Пространственное строение металлов — это кристалл, который можно представить как клетку с положительно заряженными ионами в узлах, погруженную в отрицательно заряженный электронный газ. Все атомы отдают свои валентные электроны на образование электронного газа, они свободно перемещаются внутри кристалла, не нарушая химической связи.
Теория о свободном перемещении электронов в кристаллической решетке металлов была экспериментально подтверждена опытом Толмена и Стюарта (в 1916г.): при резком торможении предварительно раскрученной катушки с намотанным проводом, свободные электроны продолжали некоторое время двигаться по инерции, и в это время амперметр, включенный в цепь катушки, регистрировал импульс электрического тока.
Признаками металлической связи являются такие характеристики :
- Многоэлектронность, поскольку в образовании металлического связи участвуют все валентные электроны;
- Многоцентровость, или делокализованность — связь соединяет одновременно большое количество атомов, содержащихся в кристалле металла;
- Изотропность, или ненаправленность — благодаря беспрепятственному передвижению электронного газа одновременно во все стороны металлическая связь является сферически симметричным.
Металлические кристаллы образуют, в основном, три вида кристаллических решеток, однако некоторые металлы в зависимости от температуры могут иметь разные структуры.
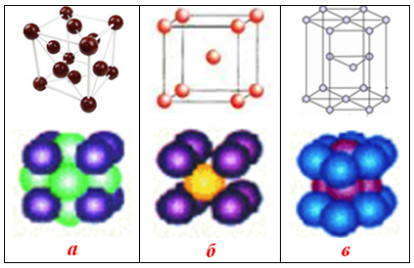
Металлическая связь существует в кристаллах и расплавах всех металлов и сплавов. В чистом виде она характерна для щелочных и щелочно-земельных металлов. У переходных d-металлов связь между атомами является частично ковалентной.
Металлическая связь вследствие наличия свободных электронов (электронного газа) и их равномерного распределения по кристаллу приводит к характерным общим свойствам металлов и сплавов, в частности, высокую тепло- и электропроводность, пластичность (т.е. способность без разрушения испытывать деформации при обычных или повышенных температурах), непрозрачность и металлический блеск, обусловленный их способностью отражать свет.
