Учение о химической связи занимает значительное место в современной химии, поскольку свойства веществ обусловлены непосредственно особенностями химических связей в них.
Химическая связь — это взаимодействие двух или нескольких атомов, в результате которого образуется химически стойкая двух- или многоатомная система (молекула, ион, радикал, кристалл).
Основные понятия о строении химических соединений изложены в теории химического строения О.М.Бутлерова (в 1861 г.), в основе которой лежит утверждение:
Атомы в молекулах соединены друг с другом химическими связями в соответствии с их валентностями в определенной последовательности. Порядок и пространственное размещение атомов и атомных групп в молекуле и характер химических связей между ними называется химическое строение.
Различают стехиометрические валентность и ковалентность (или спинвалентность).
Стехиометрическая валентность элемента — это количественная характеристика способности его атомов соединяться с атомами других элементов, которая определяет, сколько атомов водорода может присоединить один атом данного элемента или заменить его в соединениях.
Некоторые элементы в свои соединениях проявляют постоянную стехиометрического валентность. Так, одновалентными элементами являются H, Li, Na, K, Rb, Ag, Cs, F, двухвалентного — O, Ca, Ba, Mg, Sr, Zn, Cd, Hg, трехвалентными — Al, B. Но для большинства элементов характерна переменная стехиометрическая валентность, величина которой зависит от качественного и количественного состава соединения. Валентность обычно записывают римскими цифрами над химическим символом элемента.
Для определения стехиометрической валентности элемента в сложных соединениях используют определенный алгоритм. В общем случае для бинарного соединения АxВy , в которой буквами x и y обозначены индексы, а буквами m и n — валентности атомов, выполняется равенство m · x = n · y . На его основе можно вычислить валентность искомого элемента, исходя из известной валентности другого элемента:
Стехиометрическая валентность отражает только количественное соотношение атомов, но не дает четкого понимания особенностей ковалентной связи. Для объяснения о создании химических связей используется понятие ковалентности (спинвалентности).
Ковалетность (или спинвалентность ) — это количество ковалентных связей, которые образует атом; она определяется числом неспаренных электронов в атоме в основном состоянии или числом неспаренных электронов, появляющихся в атоме при его возбуждении.
Например, атом кислорода имеет в основном состоянии два неспаренных электрона, а атом азота — три. Эти электроны могут участвовать в образовании соответствующего количества ковалентных связей, поэтому ковалентность кислорода равна двум, а ковалентность азота — трем:
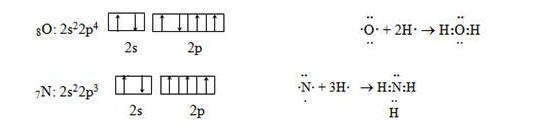
Во время химических реакций атомы могут переходить в возбужденное состояние, в котором двухэлектронные облака распадаются на одноэлектронные — спаренные электроны распариваются. Этот процесс требует затраты энергии, а при образовании химической связи неспаренными электронами энергия, наоборот, выделяется. Для того чтобы химическая связь была устойчивой, необходимо, чтобы энергия на распаривание электронов была меньше энергии, которая выделяется при образовании химических связей.
Рассмотрим атом углерода, который в основном состоянии имеет два неспаренных электрона, поэтому его ковалентность равен двум.
При переходе атома С с основного состояния (2s22p2 ) в возбужденное состояние, для обозначения которого к символу элемента справа вверху приписывается звездочка, электронная конфигурация атома изменяется (С *: 2s12p3 ), в результате чего он приобретает четыре неспаренных электрона — при этом ковалентность углерода становится равной 4:
![]()
В отличие от углерода атомы элементов N, О и F, которые размещаются в периодической системе во втором периоде после С, не могут испытывать возбуждение путем увеличения числа неспаренных электронов через распаривание спаренных электронов. Это объясняется тем, что атомы элементов азота (2s2 2p3), кислорода (2s2 2p4 ) и фтора (2s2 2p5) уже не имеют свободных р-орбиталей (а d-подуровень на втором уровне отсутствует вообще). Возбуждение этих атомов связано с переходом валентных электронов на следующий, третий, квантовый уровень, требует очень значительной энергии, которая не компенсируется выделением энергии при образовании дополнительных связей. Поэтому за счет неспаренных электронов атом N может проявлять ковалентность три, атом О — два, а атом F — один.
Атомы элементов третьего периода на внешнем энергетическом уровне имеют вакантный d-подуровень, на который при возбуждении могут переходить s- и p-электроны внешнего уровня. При этом возникает дополнительная возможность увеличения количества неспаренных электронов. Так, атом хлора в основном состоянии проявляет ковалентность один, а при возбуждении — три, пять и даже семь:
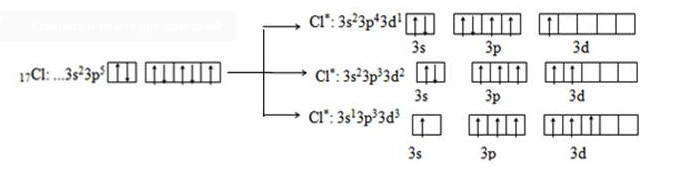
Однозначно установлено, что любая химический связь имеет электрическую природу. Это означает, что при ее образовании наиболее существенную роль играют силы взаимодействия между электрическими зарядами, носителями которых являются отрицательно заряженные электроны и положительно заряженные ядра атомов. Суть взаимодействия заключается в отталкивании одноименно заряженных частиц (ядро-ядро, электрон-электрон) и притяжении разноименно заряженных (ядро-электрон).
Понятно, что система будет устойчивой, если силы притяжения преобладают над силами отталкивания.
Рост сил притяжения при образовании молекулы по сравнению с изолированными атомами сопровождается выделением энергии, в результате чего энергия системы уменьшается. Итак, движущей силой образования химической связи является стремление изолированных атомов к выигрышу в энергии, который достигается при их объединении в систему; устойчивость системы обеспечивается возникновением области повышенной плотности отрицательного электрического заряда, притягивает к себе положительно заряженные ядра атомов.
При образовании химической связи важнейшими являются электроны внешнего слоя , то есть валентные электроны, которые удерживаются ядром наименее прочно. Именно поэтому строение электронной конфигурации атомов является определяющим фактором при рассмотрении условий образования химической связи.
Согласно предложенному Льюисом правилу октета наиболее стабильными и энергетически выгодными являются внешние оболочки с электронными конфигурациями благородных газов, то есть содержащие два (в случае ближайшего к ядру энергетического уровня) или восемь электронов.
Согласно современным представлениям в зависимости от расстояния, на котором проявляется действие химической связи, его разделяют две группы. В зависимости от степени обобществления электронной плотности рассматривают такие виды химической связи как:
- Короткодействующая химическая связь, которая образуется в результате перекрывания электронных облаков при сближении атомов, что приводит к возникновению обобщенного ( связующего ) электронного облака — области повышенной плотности электрического заряда, в зависимости от распределения которой различают следующие основные типы короткодействующего химической связи :
- ковалентная, когда общая электронное облако размещается только между двумя ядрами соседних атомов;
- ионный, при котором обобщена электронное облако настолько сильно смещается к ядру одного из атомов, практически принадлежит только ему,
- металлический, если общая Многоэлектронные облако принадлежит одновременно всем атомам, которые отдали для ее образования по одному или несколько электронов.
- локализованный химическая связь, при котором электронная плотность связи сконцентрирована (локализована) в пределах двух ближайших химически соединенных атомов;
- делокализованная химическая связь, когда электронная плотность распределена между тремя (трехцентровая) или большим количеством ядер (многоцентровая). Делокализованной наиболее часто бывает ионная связь и металлическая связь.
- Дальнодействующая химическая связь характерна, в основном, для веществ в жидком и твердом состоянии, ее действие проявляется на расстояниях, которые во много раз превышают размеры не только атомов, но и молекул. Дальнодействующая связь подразделяется на следующие виды:
- водородная связь с участием протонизованого атома водорода;
- межмолекулярное взаимодействие, для которого характерны свои специфические особенности.
Веществ, в строении которых реализуется только один из перечисленных типов химических связей, совсем немного. В большинстве случаев наблюдается совместное существование нескольких типов связей.
Любая химическая связь образуется, если это энергетически выгодно — когда сближения изолированных атомов приводит к уменьшению полной энергии системы. Для характеристики энергии системы, содержащей два изолированных атома, которые приближаются друг к другу, применяют так называемые потенциальные кривые.
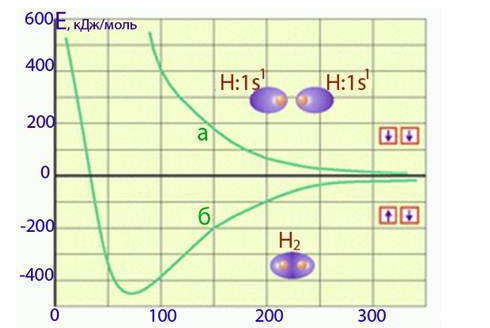
Верхняя потенциальная кривая отражает увеличение общей энергии системы по мере уменьшения расстояния между двумя атомами, так как при сближении атомов с параллельными спинами преобладают силы отталкивания между их электронными оболочками. При этом связь не образуется. Нижняя потенциальная кривая показывает уменьшение энергии системы в случае сближения атомов, имеющих антипараллельные спины, на определенное расстояние — длину связи lн, на которой происходит образование химической связи. Минимум на нижней потенциальной кривой определяет энергию связи Ен. При дальнейшем сближении атомов начинают преобладать силы отталкивания между их ядрами, поэтому общая энергия системы возрастает. Происходит взаимное отталкивание электронных оболочек, поэтому связь не образуется;
При сближении атомов, содержащих валентные электроны с антипараллельными спинами наблюдается их взаимное притяжение, в результате чего энергия системы уменьшается, возникает химическая связь и образуется молекула Н2.
Следовательно, при образовании химической связи общая энергия системы, состоящей из двух атомов, уменьшается (то есть энергия выделяется). Очевидно, что на разрыв связи необходимо потратить такую же энергию, то есть при разрыве связи энергия поглощается.
Энергия связи Eн — это мера прочности связи, определяется количеством энергии, которая выделяется в результате образования связи.
Единицы измерения энергии связи: [кДж / моль] или — реже — [эВ]. Энергия связи характеризует его прочность: чем больше энергия связи, тем он прочнее. Прочность связи ослабляется по мере увеличения длины связи.
Длина связи lн — это расстояние между ядрами химически соединенных атомов.
Длину связи измеряют чаще в нанометрах [нм], пикометр [пм], но иногда — в ангстремах [Å] (1нм = 10-9 м, 1ПМ = 10-12 м, 1Å = 10-10 м). С увеличением радиусов атомов, между которыми возникает связь, растет его длина.
Длина связи всегда меньше суммы радиусов двух соединенных атомов, поскольку образование молекулы сопровождается, кроме изменения энергии, и изменением плотности электронных облаков. Например, если при образовании связи между двумя атомами водорода, радиусы которых равны 0,053 нм, электронные облака взаимно проникали бы друг в друга, то длина связи должна была равняться удвоенному радиусу: 0,053 × 2 = 0,106 нм. На самом деле длина связи в молекуле Н2 составляет 0,074 нм. Это свидетельствует о перекрывания электронных облаков изолированных атомов, которое происходит при образовании связи, то есть в молекуле меняется плотность и форма электронных облаков по сравнению с изолированными атомами.

Кто знает-как можно изменять спин валеетного электрона?