Химические свойства веществ на практике проявляются через химическое поведение не отдельной частицы вещества, а большой их совокупности — агрегатов, ассоциатов, кристаллов и тому подобное. В газообразном состоянии силы межмолекулярного взаимодействия очень малы, так как молекулы, имеющие значительную кинетическую энергию, движутся хаотично и находятся друг от друга на большом расстоянии (по сравнению с собственными размерами). Однако в жидком и твердом состоянии частицы находятся на малых расстояниях, поэтому благодаря дальнодействующей связи силы межмолекулярного взаимодействия настолько возрастают, что благодаря им частицы удерживаются вместе — именно поэтому в конденсированном состоянии при постоянной температуре жидкости и твердые тела сохраняют свой объем постоянным.
Дальнодействующая химическая связь обусловлена наличием электромагнитных полей, образующих атомные ядра и электроны в молекулах, и возникает между отдельными частицами на расстояниях, во много раз превышают длины обычных коротких связей, поэтому соответственно в десятки раз уступает прочности уже рассмотренных типов связей. Основная характерный признак дальнодействующих связей заключается в том, что они являются результатом коллективного движения электронов и коллективного взаимодействия многих структурных единиц соединения.
Дальнодействующие химические связи условно делятся на следующие группы:
- специфическое межмолекулярное взаимодействие, к которой относится водородная связь;
- универсальная межмолекулярное взаимодействие.
Водородная связь
При образовании ковалентной связи между атомом водорода и атомом элемента с высокой электроотрицательностью (F, O, N) совместима электронное облако смещается в сторону электроотрицательному атома, сопровождается возникновением эффективного отрицательного заряда (δ-) на этом атоме и протонизации атома Н. Термин «протонизации» понимают в том смысле, что в атоме водорода, который содержит один протон в ядре и единственный электрон на электронной оболочке, при потере этого электрона (или сильном смещении в сторону) фактически остается одно ядро, то есть он превращается в протон.
Благодаря малому размеру Н+ и его высокой поляризующей способности атом Н одной молекулы может привлекаться к электроотрицательному атому соседней молекулы и даже внедряться в его электронную оболочку. Это обусловливает возникновение водородной связи.
Водородная связь — это электростатическое взаимодействие между протонизованным атомом водорода одной молекулы и атомом электроотрицательного элемента, который несет отрицательный эффективный заряд и входит в состав другой молекулы
Энергия водородной связи составляет 8-40 кДж / моль и по прочности несколько превышает энергию межмолекулярного взаимодействия, однако гораздо меньше энергии ковалентной связи. Энергия водородной связи уменьшается с увеличением температуры, поэтому она более характерна для веществ в твердом и жидком состояниях, а в газах оказывает незначительное влияние.
Рассмотрим образования водородной связи на примере фторида водорода HF. При образовании полярной ковалентной связи между атомом Н и атомом F, который характеризуется высокой электроотрицательностью, электронное облако атома водорода значительно смещается к атому фтора. В результате атом F приобретает существенный эффективный отрицательный заряд, а ядро атома H (протон) с внешней по отношению к атому фтора стороны почти теряет электронное облако. Между протоном атома Н и отрицательно заряженным атомом F соседней молекулы возникает электростатическое притяжение, что и обуславливает образование водородной связи. Вследствие водородной связи молекулы фторида водорода в твердом, жидком и даже газообразном состояниях ассоциированы в зигзагообразные цепи. В структурных формулах водородная связь обозначается точками.
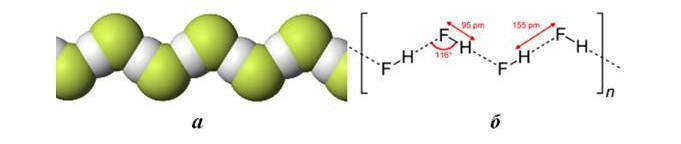
Склонность к образованию водородных связей приводит к специфическим свойствам НF. Экспериментально установлено, что при температуре, близкой к температуре кипения, его средний состав примерно соответствует формуле (НF)4. Даже в водном растворе связь между молекулами HF настолько прочна, что «одноосновная» фтороводородная кислота дает кислые соли, например КНF2 с кислотным остатком [F-H • • • F] —. В кристаллическом состоянии HF образует орторомбической кристаллы, которые складываются в цепные структуры.
Ассоциация молекул HF вызывает аномально высокие температуры плавления и кипения по сравнению с водородными соединениями других элементов подгруппы VIIА. То, что кислота НF в отличие от HCl, HBr и HI принадлежит к слабым электролитам, также является результатом ассоциации молекул HF в водородном растворе.
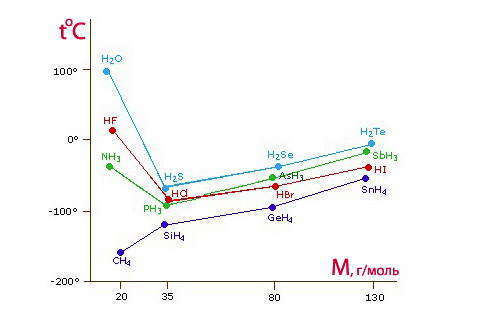
Подобная картина наблюдается и среди соединений элементов VIА-подгруппы с водородом (H2O, H2S), среди которых вода занимает особое место: она также характеризуется аномально высокими температурами плавления и кипения. Водородные связи в ней образуются за счет взаимодействия протонизованого атома Н (δ+) одной молекулы и атомом В другой молекулы, на котором сосредоточен частичный отрицательный заряд (δ-).
Водородные связи в жидкой воде способствуют образованию ассоциатов молекул H2О — димеров, триммеров и тому подобное. Вследствие образования водородной связи в кристалле льда, например, молекулы воды ассоциированные и имеют ажурную пространственную структуру, в которой каждый атом кислорода расположен в центре тетраэдра, вершины которого занимают атомы водорода. Именно этим обусловлено более низкая плотность твердой воды (льда) по сравнению с жидкой.
В результате водородную связь разделяют на два типа:
- Межмолекулярная водородная связь, осуществляемый между отдельными молекулами, например, Н2О, HF, NH3, H2O, между молекулами воды и спиртов или органических кислот;
- Внутримолекулярная водородная связь, возникающая между атомами одной большой молекулы, например, в ионах [HF2] ¯, [H (H2O)2]+ ) и во многих органических соединениях — при формировании структур белков, полисахаридов, двойной спирали ДНК (α-спирали, β-складки) и др.
Водородная связь играет важную роль при ассоциации молекул, кристаллизации, растворении, образовании кристаллогидратов, электролитической диссоциации, в химии органических соединений, полимеров, белков. Водородные связи заметно влияют на физические свойства воды и многих органических жидкостей (спиртов, карбоновых кислот, амидов кислот, эфиров).
Интересен такой факт. Наличием водородных связей объясняется голубой цвет чистой воды в довольно значительной ее толще. Когда одна молекула Н2О колеблется, она заставляет колебаться и соединенные с ней водородными связями другие молекулы. На возбуждение таких колебаний тратятся красные лучи солнечного света как наиболее соответствующие по энергии. Поэтому из солнечного спектра «отфильтровываются» красные лучи (их энергия поглощается и рассеивается молекулами воды вследствие их колебания в виде тепла), но начинает проступать другой участок спектра — голубой, окрашивающий воду голубым цветом. Однако для этого солнечному лучу необходимо проникнуть не менее чем в двухметровый слой чистой воды.
Межмолекулярное взаимодействие
Вторая разновидность дальнодействующей химической связи — универсальное межмолекулярное взаимодействие, которое в зависимости от своей природы и механизма возникновения подразделяется на следующие составляющие: ориентационное, индукционное, дисперсионное и межмолекулярные силы отталкивания.
В веществах с молекулярной структурой действуют электростатические межмолекулярные силы — так называемые вандерваальсовские силы. Наиболее существенным признаком вандерваальсовских сил является универсальность, которая заключается в их действия между всеми молекулами и атомами без исключения. Они объединяют все виды межмолекулярного притяжения и отталкивания. Вандерваальсовские силы возрастают при сближении молекул и при увеличении суммарного количества электронов. Они хоть и гораздо слабее ковалентные, но действуют на значительно больших расстояниях и поэтому влияют на структурные, спектральные и другие свойства веществ. Их основу составляют кулоновское взаимодействие между электронами одной молекулы и ядрами и электронами многих других молекул, которая на определенном расстоянии уравновешивается, создавая устойчивую многомолекулярных систему.
Диполь-дипольное притяжения происходит в том случае, когда энергия притяжения превышает тепловую энергию молекул — обычно это наблюдается в твердых и жидких веществах, которые содержат полярные молекулы (например, HF, H2O, NH3, НСl). С повышением температуры она заметно ослабевает, поскольку тепловое движение молекул мешает их взаимной ориентации.
Между постоянным диполем полярной и индуцированным диполем неполярной молекул осуществляется индукционная взаимодействие, в результате которого индуцированный диполь увеличивает дипольный момент полярной молекулы, а сама неполярная молекула деформируется. Эта деформация тем сильнее, чем больше дипольный момент полярной молекулы и чем выше поляризуемость неполярной. Индукционная взаимодействие может происходить также и в веществах с полярными молекулами, но в этом случае оно гораздо слабее ориентационного.
Согласно квантовой механике мгновенные диполи синхронно возникают во всех веществах в конденсированном состоянии. При этом ближайшие участки двух соседних молекул заряжаются электричеством противоположного знака, что и приводит к их взаимному притяжению. Все три вида вандерваальсовского взаимодействия характерны для веществ, находящихся в конденсированном состоянии, и общая энергия притяжения между молекулами равна сумме энергий ориентационного, индукционного и дисперсионного эффектов. В газообразном состоянии вандерваальсовские силы проявляются только при повышенном давлении, когда расстояния между молекулами становятся достаточными для межмолекулярного взаимодействия.
- Ориентационное взаимодействие обусловлено полярностью молекул. Полярные молекулы, в которых центры тяжести положительного и отрицательного зарядов не совпадают, ориентируются таким образом, чтобы полюса с противоположными знаками зарядов размещались рядом, что и обусловливает возникновение притяжения между ними. Ориентационное межмолекулярное взаимодействие (диполь-дипольное) — это взаимодействие в конденсированном состоянии веществ, при котором соседние молекулярные диполи размещаются друг к другу противоположно заряженными полюсами, что обеспечивает их взаимное притяжение.
- Индукционное взаимодействие возникает при взаимодействии полярной и неполярной молекул. При приближении полярной молекулы к неполярной, но способной к поляризации, полярная молекула способствует возникновению в ней приведенного (индуцированного) диполя. Индукционное межмолекулярное взаимодействие — это взаимодействие, которое обусловлено действием индуцированных диполей молекул.
- Дисперсионное взаимодействие заключается в образовании мгновенных диполей между неполярными молекулами. Вследствие движения молекул появляется асимметрия распределения положительных и отрицательных зарядов, что приводит к возникновению мгновенных диполей, способных существовать очень короткое время — порядка 10-8 с. Попеременно возникающие диполи различных молекул вследствие своего движения ориентируются, как правило, таким образом, что между ними действует то притяжение, то отталкивание, однако благодаря большой скорости движения электронов, силы притяжения преобладают над силами отталкивания. Дисперсионное межмолекулярное взаимодействие — это взаимодействие между неполярными молекулами, которое образуется за счет мгновенных микродиполей, образующихся в результате движения электронов в атомах и колебаний ядер.
- Силы отталкивания электронных оболочек молекул — это четвертая составляющая сил межмолекулярного взаимодействия. Энергия сил отталкивания не превышает 16 кДж / моль, то есть в любом случае она меньше, чем энергия сил межмолекулярного притяжения.
