Прежде чем мы сформулируем основной закон термодинамики, давайте вспомним основные понятия и определения физической химии. Химические реакции связаны с различными физическими процессами: теплопередачей, поглощением или выделением теплоты, поглощением или излучением света, электрическими явлениями, изменением объема и тому подобное. В химических реакциях происходят связанные физические и химические явления, изучение этой взаимосвязи — основная задача физической химии.
Основные понятия и определения термодинамики
Главное внимание в физической химии уделяется исследованию законов протекания химических процессов, состояния химического равновесия, изучению строения и свойств молекул, что позволяет решать основную задачу физической химии — понимать прохождение химического процесса и его конечный результат. Это дает возможность управлять химическим процессом, то есть обеспечить более быстрое и полное прохождение реакции. Такие важнейшие производственные процессы, как синтез и окисление аммиака, получение серной кислоты, производство этанола из природного газа, крекинг нефти — стали возможными в результате успехов физической химии.
Наиболее важными разделами физической химии являются: химическая термодинамика и химическая кинетика. Каждый раздел имеет свою внутреннюю структуру и довольно часто рассматривается отдельно. Например, в химической термодинамике выделяют следующие подразделения: основные законы, термохимия, учение о растворах, химическую и фазовую равновесие и тому подобное. Как отдельные науки от физической химии отделились коллоидная химия и электрохимия.
Сегодня физическая химия — отдельная дисциплина со своими методами исследования, которая является теоретической базой прикладных химико-технологических дисциплин. Она основана на применении методов квантовой химии, химической термодинамики и химической кинетики.
Термодинамика исторически возникла как учение о тепловых машины. В дальнейшем, когда выяснилось, что ее основные положения имеют принципиальное значение, термодинамика сформировалась в отдельную фундаментальную научную дисциплину, которая изучает взаимные превращения теплоты, работы и различных видов энергии. Термодинамика базируется на экспериментально установленных законах — принципах термодинамики.
Химическая термодинамика применяет положения и законы общей термодинамики для изучения химических явлений. Сегодня применение термодинамических методов для исследования химических реакций помогает выявить реакции в системе возникающие при заданных температуре, давлении и концентрациях, которые могут проходить спонтанно (т.е. без затрат работы извне), выяснить предел спонтанного их прохождения и как надо менять условия, чтобы процесс проходил в нужном направлении и степени. На основе термодинамических методов можно определить также максимальное количество работы, которая может быть получена от системы или минимальное количество работы, которую необходимо затратить извне для осуществления процесса. Вместе с тем термодинамические методы позволяют определить тепловые эффекты различных процессов. Все это имеет большое значение и для теоретического исследования, и для решения задач прикладного характера.
Одним из основных понятий химической термодинамики является понятие термодинамической системы. Система — это тело или группа тел, которые взаимодействуют энергетически, и которые мысленно или физически отделены от тел, которые их окружают. Тела, которые окружают термодинамическую систему, называются внешней или окружающей средой.
Системы классифицируют на изолированные, закрытые и открытые. Изолированная система не обменивается с окружающей средой ни веществом, ни энергией. Закрытая система обменивается с окружающей средой только энергией. Открытая система обменивается с окружающей средой и веществом, и энергией.
Также системы делятся на гомогенные и гетерогенные. Гомогенная система — это система, внутри которой нет поверхностей, отделяющие одни части системы от других (к примеру, смеси газов). Гетерогенная система — это система, состоящая из двух или нескольких частей, различных по физическим свойствам или химическому составу и отделенных поверхностями распределения (лед и вода, жидкость и ее пары, две жидкости, которые не смешиваются).
Фаза -это гомогенная часть гетерогенной системы, имеет одинаковый состав, физические и химические свойства, отделенная от других частей поверхностью раздела, при переходе через которую происходит скачкообразное изменение ее свойств. Фазы бывают твердые, жидкие и газообразные.
Компонент термодинамической системы — это некоторая вещество, входящее в систему, которую можно выделить из системы и которая может существовать в свободном состоянии.
Состояние термодинамической системы может определяться совокупностью его физических и химических свойств. Все величины, характеризующие любое свойство рассматриваемой системы, называются термодинамическими параметрами. Состояние термодинамической системы, которая состоит из чистого вещества и находится в равновесии, определяется параметрами Р, V, T. Связь между этими параметрами при отсутствии силовых полей в общем виде описывается уравнением f (P, V, T) = 0. Это уравнение называется уравнением состояния. Для определения состояния термодинамической системы при отсутствии каких-либо действий со стороны окружающей среды достаточно задать два параметра. Третий параметр может определяться из уравнения состояния. Заданные параметры называются независимыми параметрами.
Формы обмена энергией: теплота и работа
В химической термодинамике рассматриваются два основных способа обмена энергией между системой и окружающей средой: обмен энергией в виде теплоты и обмен энергией в виде работы. Первый способ обмена энергией осуществляется при непосредственном контакте тел, которые имеют разную температуру. При этом энергия передается от тел с большей температурой к телам с меньшей температурой.
Теплота процесса это энергия, которая передается одним телом другому при их взаимодействии, которая зависит только от температур этих тел, и которая не связана с переносом вещества.
Второй способ обмена энергией обусловлен наличием силовых полей или внешнего давления. При таком обмене термодинамическое тело должно двигаться в силовом поле или под действием внешнего давления изменять свой объем. Такой способ обмена энергией называется передачей энергии в виде работы, а энергия, которая передается одним телом другому при их взаимодействии, не зависит от температуры этих тел и не связана непосредственно с переносом тепла от одного тела к другому, называется работой процесса.
Термодинамическая система при определенных условиях может перейти в состояние, характеризующееся постоянством ее параметров по времени. Такое положение системы называется состоянием равновесия. Состояние системы, при котором отсутствует равновесие, называется неравновесным.
Изменения состояния термодинамической системы, связанные с изменениями ее параметров, называется термодинамическим процессом. Процесс изменения состояния системы может быть равновесным и неравновесным. Равновесным называется процесс, который рассматривается как непрерывная череда равновесных состояний системы. Во всех частях такой системы давление, температура, удельный объем и другие физические свойства одинаковы. Процесс, в котором система проходит через неравновесные состояния, называется неравновесным процессом.
Термодинамические процессы бывают обратимыми и необратимыми. Обратимым является равновесный процесс, если при прохождении его в обратном направлении система приходит в исходное состояние и в окружающей среде при этом не происходит никаких изменений. Процессы, которые не удовлетворяют этому условию, является необратимыми. К ним относятся все неравновесные процессы, а также равновесные процессы, которые допускают обратимость, но с изменением окружающей среды.
Формулировка первого закона термодинамики
Первый закон термодинамики представляет собой постулат, вытекающий из многовекового опыта человечества. Существует несколько формулировок первого закона термодинамики, которые равноценны друг другу и вытекают друг из друга. Первый закон термодинамики непосредственно связан с законом сохранения энергии: в любой изолированной системе запас энергии остается постоянным. Отсюда следует закон эквивалентности различных форм энергии: различные формы энергии переходят друг в друга в строго эквивалентном количестве.
Первый закон термодинамики можно сформулировать так: вечный двигатель первого рода невозможен, то есть невозможно построить машину, которая выполняла бы механическую работу, не тратя на это соответствующего количества энергии.
Еще одна формулировка закона: изменение внутренней энергии системы при переходе из одного состояния в другое равно сумме количества теплоты, подведенной к системе извне и работе внешних сил действующих на нее: ∆U=Q+A
Как уже отмечалось, система может обмениваться энергией с окружающей средой в форме теплоты и работы. Опыт показывает, что изменение внутренней энергии системы равно алгебраической сумме этих двух величин: dU = δQ — δA
Знак «минус» перед величиной работы соответствует рассматриваемому правилу знаков. Выражение часто записывают в виде: δQ = dU + δA
Эти оба выражения являются математическими формами первого закона термодинамики, который можно сформулировать так: теплота, которая поглощается системой, расходуется на изменение внутренней энергии и совершение системой работы.
Для случая, когда единственным видом работы, которую осуществляет система, является работа сил расширения: δQ = dU + PdV.
В термодинамике важное значение имеет свойство системы, которая получила название — теплоемкость. Теплоемкость — это количество предоставленной системе теплоты которая отнесена к наблюдаемому при этом повышении температуры. Различают среднюю и истинную теплоемкости:
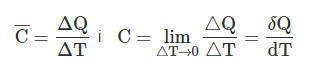
Найдем связь между ними
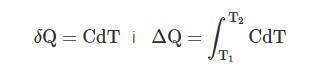
Подставляя значение ΔQ в выражение для С, получим
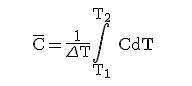
Теплоемкость, как правило, рассчитывают или на 1 кг вещества (удельная теплоемкость), либо — на 1 моль (молярная). В физической химии используют преимущественно молярные величины.
Для газов существенное значение имеют теплоемкости при постоянном объеме СV и при постоянном давлении СР
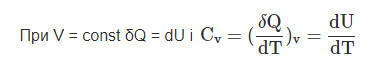
При Р = const и Н = U + PV, или U = H-PV, находим dU = dH-PdV и подставляем это значение в формулу для первого закона термодинамики, получаем
- δQ = dH — PdV + PdV = dH
Итак,
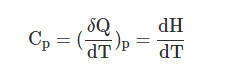
Чтобы найти связь между С Р и С V , надо продифференцировать по температуре выражение Н = U + PV:
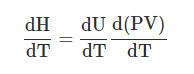
Теплоемкость подлежит правилу аддитивности: теплоемкость сложных термодинамических систем равна сумме теплоемкостей их составных частей:
- С = С1 + С2 + С3 + … + Ск
Зависимость теплоемкости индивидуальных веществ от температуры, как правило, описывают эмпирическим ступенчатым рядом:
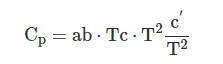
Выводы
В данной статье рассмотрены понятия основных величин, используемых в химической термодинамике. Приведена классификация систем и процессов. Введены понятия внутренней энергии, энтальпии, теплоты, работы. Рассмотрены понятия функции состояния системы. Сформулирован первый закон термодинамики и на этом основании выведено уравнение для расчета теплоты и работы в основных термодинамических процессах.

Из какого закона вытекает первый закон термодинамики?
Первый закон термодинамики связан и прямо вытекает из закона сохранения энергии.