Каким образом мы узнали, что атомы действительно существуют? Мы рассказывали о них с большими подробностями в статье про атомы химических элементов , но ведь они слишком малы, чтобы увидеть их с помощью оптического или даже электронного микроскопа. Тем не менее легко наблюдать некоторые явления, свидетельствующие об их существовании.
Когда заряженная частица, например ядро водорода или гелия, проходит через влажный газ, она оставляет за собой след пара, подобный тому, который оставляет самолет высоко в небе. Этот след мы можем увидеть или сфотографировать даже без микроскопа.
Соединение атомов в молекулы
Хотя до последнего времени не удавалось разглядеть атом, но зато можно увидеть молекулу, которая является химической комбинацией атомов. Изредка встречаются настолько большие молекулы, что их уже можно наблюдать с помощью электронного микроскопа, хотя они слишком малы, чтобы отражать более длинные волны видимого света, и поэтому их не удается увидеть с помощью простого микроскопа.
Сколько атомов содержит молекула
Вирус — это и есть огромная молекула, одна из самых больших среди известных молекул. Вирус полиомиелита, принесший так много бед, представляет собой сферическую молекулу, содержащую много тысяч атомов. Его можно увидеть с помощью электронного микроскопа при увеличении в 180000 раз.
В 1957 г. ученый из Пенсильванского университета Эрвин Мюллер получил первую действительную фотографию отдельных атомов. Слева показаны атомы вольфрама, расположенные в кристаллической решетке на поверхности очень тонкой металлической иглы. Они наблюдались Мюллером в поле ионного микроскопа. Каждая маленькая точка — это отдельный атом, яркие точки — группы из нескольких атомов. Увеличение здесь составляет около 2000000.
В Массачузетском технологическом институте доктор Мартин Бюргер при помощи рентгеновских лучей зафиксировал расположение отдельных атомов в кристалле пирита. Пирит — дисульфид железа — является соединением железа и серы. Каждая ячейка пирита содержит 1 атом железа и 2 атома серы.
Атомы, конечно, чрезвычайно малы. Один атом железа имеет диаметр менее трех стомиллионных долей сантиметра. На фотографии нельзя детально рассмотреть атом, однако на ней ясно видно положение отдельных атомов в кристалле.
Как связаны атомы в молекулах
Теперь выясним вопрос, как заставить атомы различные элементы, например железо и серу, соединиться и образовать молекулы?
Если мы тщательно перемешаем железные опилки с серой, то смесь все еще будет оставаться железными опилками и серой. Их легко вновь разделить. Для этого нужен только магнит. Таким образом, железо и сера при смешивании не образуют химического соединения. Они образуют смесь отдельных атомов железа и серы, просто лежащих рядом. Однако, если мы поместим смесь в тигель и нагреем ее, то атомы железа и серы образуют химическое соединение.
Нагретые вместе, они теряют свою индивидуальность и становятся соединением, а именно — сульфидом железа, которое отличается по всем своим свойствам как от железа, так и от серы. Каждая молекула этого сульфида железа, или FeS, имеет 1 атом железа и 1 атом серы. Это вещество очень похоже на дисульфид железа, формула которого FeS2. Совсем легко приготовить соединение из магния, потому что для этого требуется только небольшое количество металлического магния и тепло. Необходимый кислород будет поступать из воздуха.
Можно взвесить магний и убедиться, что при горении он увеличивается в весе, а не теряет его. Это происходит потому, что магний соединяется с кислородом воздуха, образуя новое соединение — окись магния MgO. Окись магния, конечно, тяжелее первоначального магния, так как мы должны прибавить к весу атома магния еще вес атома кислорода. Полученная окись магния не похожа ни на магний, ни на кислород.
Процесс соединения железа и серы или магния и кислорода называется химической реакцией. Химические формулы для обеих реакций очень просты:
- Fe + S -> FeS (железо плюс сера образуют сульфид железа)
- 2Mg + 02 -> 2MgO (магний плюс кислород образуют окись магния).
До сих пор мы видели, как химик получает соединение из двух элементов, но не выяснили вопрос, почему происходит реакция. Существует очень много способов, которыми атомы могут соединяться в молекулы, но любой из них всегда состоит в перегруппировке атомных электронов на орбитах.
Перегруппировка электронов в атомах фактически и определяет химические процессы.
Первый горизонтальный ряд периодической системы содержит только два элемента — водород и гелий. Каждый из них имеет одну электронную оболочку. Второй горизонтальный ряд состоит уже из восьми элементов с двумя электронными оболочками. Можно сказать, что у каждого из элементов имеется «восьмиместная» внешняя оболочка, причем одно или несколько «мест» на ней занято электронами.
Как мы уже видели, первый элемент этого ряда — литий — имеет только один электрон на внешней оболочке, бериллий — два, и т. д., вплоть до неона, у которого все восемь мест заняты электронами.
Подобное положение имеет место и в других пяти горизонтальных рядах периодической таблицы. С первого элемента каждого ряда начинается заполнение новой оболочки.
В каждой вертикальной колонке периодической системы находятся элементы, имеющие одинаковое число электронов на внешней оболочке. Водород, литий, натрий, калий, рубидий, цезий, франций — все они имеют единственный электрон на внешней оболочке.
На другом, правом краю периодической таблицы находятся элементы, у которых внешние оболочки заполнены,— это гелий, неон, аргон, криптон, ксенон и радон.
Элементы каждой вертикальной колонки являются членами одного и того же семейства. А так как все они имеют одинаковое число электронов на своих внешних оболочках, то обладают сходными химическими свойствами.
Не считая самого водорода, элементы в первой колонке — химические родственники водорода — называются щелочными металлами. Каждый из них имеет единственный электрон, который способен перемещаться в химических реакциях.
Такая реакция имеет, например, место, когда натрий соединяется с хлором, образуя молекулы всем известной пищевой (поваренной) соли. На двумерной модели атома натрия можно видеть, что он имеет 11 протонов в ядре и 11 электронов, уравновешивающих положительный заряд ядра: два электрона на первой оболочке, 8 — на второй и 1 — на третьей.
В атоме хлора 17 электронов — 2, 8 и 7 на каждой из оболочек. У натрия имеется один внешний электрон, в то время как хлору не хватает одного электрона до заполнения оболочки. Они образуют химическое соединение тогда, когда единственный электрон с внешней оболочки натрия перепрыгнет и заполнит внешнюю оболочку атома хлора. Натрий, рставшийся без электрона, становится положительно заряженным. Один из его отрицательных зарядов (электрон) прибавился к хлору. Два атома теперь имеют противоположные заряды и, таким образом, удерживаются вместе сильной электрической связью.
Собственно, правильнее говорить не об атомах, а ионах, имеющих противоположные заряды, так как атомы, которые лишились своей нейтральности путем присоединения или потери электронов, называются ионами.
Чтобы осуществить на практике этот эксперимент, мы должны взять бутылку с хлором, который представляет собой желтовато-зеленый ядовитый газ, и бросить в нее кусочек мягкого ядовитого металла — натрия. Вскоре, когда натрий и хлор соединятся, образуется пищевая соль NaCl. Конечно, только очень большое число молекул соли или какого-нибудь другого соединения, сгруппировавшихся вместе, может образовать заметные количества его.
Натрий и хлор растут вместе в виде кристаллов. Ионы натрия и ионы хлора, перемежаясь между собой, образуют кубическую решетку. Кристаллы соли обычно несовершенны и имеют различные дефекты. Однако кристаллы, выращенные без нарушений, обладают отчетливой кубической структурой. Изображенный на предыдущей странице сложный кристалл включает огромное число атомов — приблизительно 1025.атомов натрия и столько же атомов хлора.
Это число выглядит очень внушительно: 10 000 000 000 000 000 000 000 000.
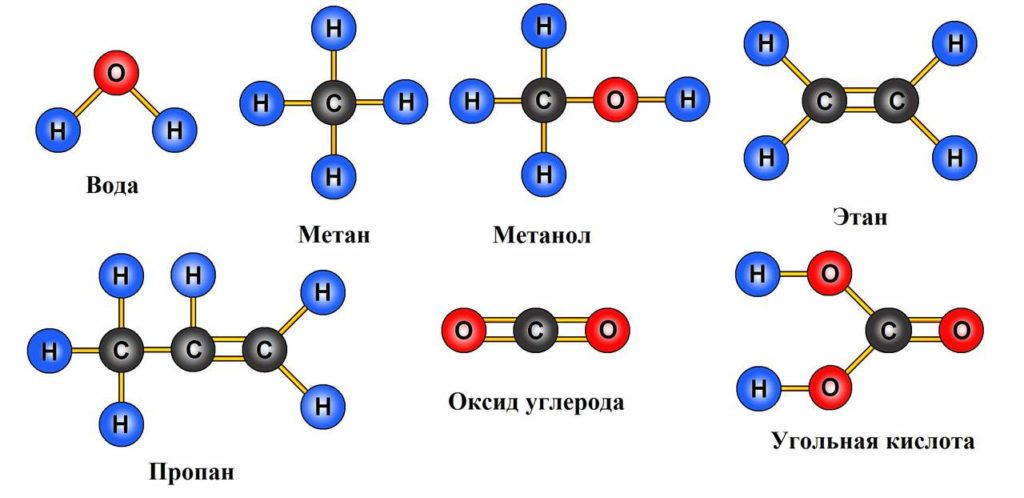
Поваренная соль иллюстрирует только один из способов соединения атомов при образовании молекул. Этот способ, однако, отнюдь не основной. Другим примером может служить вода. Пусть у нас есть два атома водорода, каждый из которых имеет по одному электрону, и один атом кислорода. Кислород, содержащий восемь протонов в ядре, имеет также 8 электронов. Два электрона находятся на внутренней оболочке и шесть — на внешней, при этом на ней остаются два незаполненных места, которые, вероятно, могут быть заняты электронами двух атомов водорода.
Но в данном случае электроны не передаются, как это было с натрием и хлором. Вместо этого два атома водорода приближаются к атому кислорода и владеют своими электронами совместно с ним. Соединение атомов в молекулы по такому способу называется по-разному: или совместное владение электронами, или связь с помощью электронных пар, или, наконец, ковалентная связь. Огромное число молекул образуется именно по этому принципу.
В таких молекулах возникают ничтожные электрические токи, постоянно меняющие направление. Это обстоятельство заставляет молекулы притягиваться друг к другу и сцепляться вместе, образуя видимые количества воды, сахара или других веществ. При отсутствии сил, удерживающих молекулы вместе, все молекулы передвигались бы независимо, как в воздухе, и любое вещество было бы газообразным.