Спектроскоп стал одним из наиболее мощных инструментов современной научной лаборатории. Его назначение — анализировать свет. Это достигается путем разложения света от данного источника, подобно тому как дождевые капли разлагают солнечный свет во все цвета радуги. В приборе, конечно, вместо дождевых капель используется призма или дифракционная решетка. Получающийся в результате разложения спектр состоит из специфических цветов — или длин волн,— присутствующих в любом данном пучке света.
С помощью спектроскопа ученые смогли создать своего рода систему атомных «отпечатков пальцев»: вещество распознается (идентифицируется) по составу света, который оно испускает.
Именно спектроскоп позволил открыть один из неизвестных элементов, предсказанных Менделеевым.
Мы можем распознавать элементы — правда, грубо — по цвету испускаемого ими света. Раствор натрия, внесенный в пламя горелки, дает яркий желтый свет. Соединения меди, внесенные в пламя, излучают яркий зеленый свет, а соединения стронция — малиновый.
Свет, испускаемый каждым из этих соединений, является характерным для элемента и поэтому может быть использован для его идентификации. Чтобы рассмотреть свет во всех его деталях, мы можем пропустить его через призму или через дифракционную решетку, которая действует подобно длинному ряду микроскопических призм, расположенных на равном расстоянии друг от друга.
Призма или дифракционная решетка отклоняет свет в зависимости от его цвета. Когда белый свет — который состоит из всех цветов — проходит через призму, то красный цвет отклоняется меньше других. Оранжевый свет отклоняется несколько сильнее, чем красный, желтый — еще сильнее; далее идут зеленый, синий и, наконец, фиолетовый.
Если в качестве источника используется угольная дуга, то она испускает почти белый свет, потому что характеристический свет углерода проходит через весь спектр (как называют набор цветов)— от красного через оранжевый, желтый, зеленый, голубой, синий и до фиолетового.
Угольная дуга, служившая источником света в первых спектроскопах, состоит главным образом из двух угольных палочек (электродов) диаметром около полутора сантиметров с зазором между ними. Одна угольная палочка вставляется горизонтально слева, а другая направляется под углом снизу. Концы их встречаются внутри металлического кожуха. Зазор между ними находится как раз позади черного кружочка, который представляет собой темно-красное смотровое окошко. Свет от дуги выходит справа.
Пучок света проходит через линзу, вертикальную щель, еще одну линзу и затем через прямоугольную дифракционную решетку. Спектр проектируется на экран, расположенный справа.
Когда сильный электрический ток проходит через угольные палочки (электроды), то в зазоре между ними проскакивает искра, и возникает так называемая дуга; выделяющееся при этом тепло и электрический ток возбуждают атомы углерода, которые в результате испускают типичный для углерода свет.
Если один из угольных электродов предварительно опустить в раствор какого-нибудь другого элемента, свет этого элемента наложится на свет углерода.
Например, если один из угольных электродов вначале погрузить в раствор натрия, захватив таким образом некоторое количество его, то результирующий спектр дуги будет уже спектром углерода и натрия. Свет натрия четко выделяется, так как его спектр очень сильный в желтой области, тогда как свет от углерода относительно равномерно охватывает весь спектр.
Даже на грубом спектре будут ясно видны эти различия. Спектр углерода представляет собой почти сплошную полосу, отчасти сходную с белым солнечным светом.
Если использовать уголь, смоченный в растворе натрия, сцектр, прошедший через дифракционную решетку, пополнится сильной желтой компонентой.
Желтый свет испускается и натриевой лампой. Предметы, окрашенные в белый или желтый цвет, будут очень хорошо отражать натриевый свет. Однако одежда, которая в обычном свете является красной, в натриевом свете будет казаться темно-коричневой, потому что красный цвет не содержится в спектре натрия, и этот цвет не будет отражаться красным материалом.
Если мы пропитаем угольный электрод раствором кальция, то результирующий спектр будет иметь цвета, характерные для кальция.
Натриевый свет, проходящий через решетку или призму, дает только лишь узкую желтую линию.
Мы пока говорили об эмиссионном спектре элемента, т. е. о таком свете, который испускается раскаленным элементом. Но элемент может и поглощать свет, причем в точности такой, какой он способен испускать.
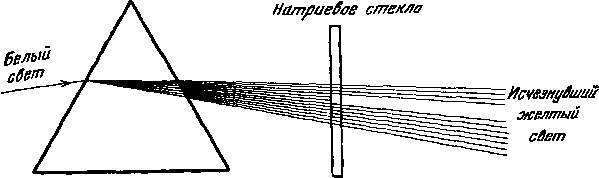
Натрий, например, может поглощать желтый свет той же длины волны, что и испускается натриевой лампой. Стекло, содержащее натрий, если его поставить перед угольной дугой, будет поглощать и, следовательно, экранировать свет, имеющий ту же самую длину волны. В свете, прошедшем через призму или дифракционную решетку, изготовленные из такого стекла, будет отсутствовать натриевый желтый свет. Характерный натриевый эмиссионный спектр в этом случае имеет «обратный» вид и подобен в этом смысле негативу, где вместо ярких линий позитива оказываются темные.
Так что, поставив кусочек стекла, содержащего натрий, между чистой угольной дугой и нашей решеткой, мы получим спектр углерода минус спектр натрия. Это и есть абсорбционный спектр или спектр черных линий элемента натрия.
Таким образом, имеются два способа идентификации элемента с помощью спектроскопа:
- по характеру цвета, т. е. по длинам волн, которые элемент испускает, когда он возбужден, и
- наоборот, по цвету, поглощаемому элементом и, следовательно, «вычеркиваемому» из спектра.
Очевидно, имея в своем распоряжении спектроскоп, мы обладаем мощным средством обнаружения как неизвестных веществ, так и известных элементов и их соединений.
Более того, этот метод настолько чувствителен, что может быть использован для обнаружения одной трехсотмиллионнои доли грамма такого элемента, как, например, натрий. Работа спектроскопа не зависит от расстояния до источника света, и поэтому, анализируя свет, испускаемый Солнцем или звездами, можно обнаружить элементы, находящиеся соответственно на Солнце или в звездах.
Механизм поглощения или испускания света связан с положением внешних электронов в атомах. Простейшим примером может служить атом водорода с его ядром — протоном и единственным электроном, вращающимся по орбите вокруг ядра. Когда атом поглощает свет, электрон перепрыгивает на другую орбиту с большим радиусом. Когда же атом испускает свет, выделяя при этом энергию, электрон перепрыгивает внутрь, на меньшую орбиту.
Аналогичная схема имеет место и для внешнего электрона атома лития или, скажем, натрия. Когда электрон перепрыгивает на меньшую орбиту, атом испускает характерный для него свет.