Все свойства элементов, которые определяются электронной оболочкой атома, закономерно изменяются в периодах и группах периодической системы. Но поскольку у ряда элементов-аналогов электронные структуры не тождественны, а только подобны, то при переходе от одного элемента к другому в подгруппах наблюдается не простое повторение свойств, а их более или менее четко выраженное закономерное изменение, которое мы называем периодичностью свойств элементов.
Химическая природа элемента обусловлена способностью его атома отдавать или присоединять электроны, которая количественно характеризуется энергией ионизации, сродством к электрону и электроотрицательностью и зависит от радиуса атома.
Атомные и ионные радиусы
Вследствие волнового характера движения электрона атом не имеет четко очерченных границ, поэтому измерить абсолютное значение размера атома невозможно.
В последнее время распространилось понятие об орбитальных радиусах. Орбитальный радиус — это расстояние от ядра до наиболее удаленного от него максимума распределения электронной плотности. Поэтому атом в основном состоянии может иметь только один орбитальный радиус, а в возбужденном — множество значений rорб. Практически имеют дело с радиусами атомов, которые соединены друг с другом тем или иным типом химической связи. Такой радиус рассматривают как эффективный радиус атома, то есть, который проявляет себя в действии. Эффективные радиусы определяют при изучении строения молекул и кристаллов.
По этой причине значение атомных радиусов, приводимые в различных справочных изданиях, иногда существенно отличаются. Однако несмотря на различия в величинах атомных радиусов для одного и того же элемента, сохраняется общая закономерность, отражающая зависимость атомных радиусов от заряда ядра атома Z, которая имеет периодический характер.
Зависимость орбитальных радиусов r (1Å = 10 -10 м) элементов от порядкового номера Z:
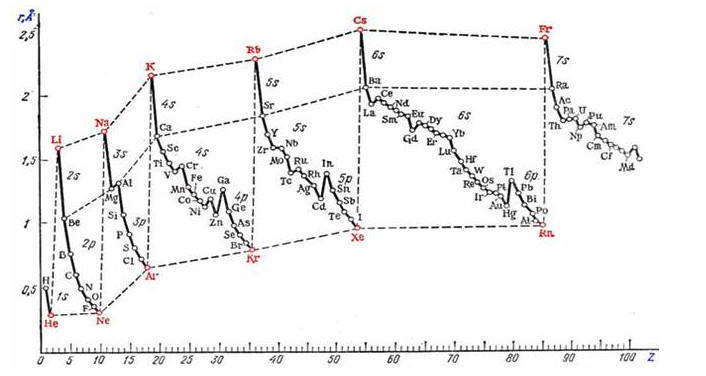
В пределах одного периода с повышением Z наблюдается тенденция к уменьшению размеров атомов. Это объясняется растущим притяжением электронов внешнего слоя к ядру по мере увеличения его заряда.
При переходе от предыдущего к следующему периоду атомные радиусы увеличиваются, поскольку начинается застройка нового энергетического уровня, более удаленного от ядра. В результате в пределах главных подгрупп размеры атомов увеличиваются с ростом зарядов ядер. В побочных подгруппах размеры атомов изменяются в меньшей степени, особенно для переходных d-металлов пятого и шестого периодов, для которых радиусы атомов примерно одинаковы. Это объясняется тем, что увеличение радиусов за счет увеличения количества квантовых уровней при переходе от пятого к шестому периода компенсируется лантаноидным сжатием (уменьшением атомных радиусов элементов от 57La до 71Lu), которое вызвано заполнением 4f-подуровня. Благодаря этому d-элементы-аналоги пятого и шестого периодов имеют особенно близкие свойства. Так, в IIIB-подгруппе (Ti-Zr-Hf) у последних двух элементов радиусы одинаковы (0,145 нм), поэтому они очень похожи между собой по физическим и химическим свойствам и значительно отличаются от Титана, радиус которого равен 0,132нм.
Потеря атомом электронов приводит к уменьшению его эффективных размеров, а присоединение избыточных электронов — к увеличению. Поэтому радиус положительно заряженного иона (катиона) всегда меньше, а радиус отрицательно заряженного иона (аниона) всегда больше радиуса соответствующего электронейтрального атома. Так, радиус атома калия равна 0,236нм, а радиус иона калия К+ — 0,133нм, радиусы атома хлора и иона хлора Сl— соответственно равны 0,099 и 0,181нм.
При этом радиус иона тем сильнее отличается от радиуса электронейтрального атома, чем больше заряд иона. Например, радиусы атома хрома и ионов Cr2+ и Cr3+ равны соответственно 0,127, 0,083 и 0,064нм.
В пределах одной подгруппы радиусы ионов одинакового заряда растут с увеличением заряда ядра. Такая закономерность объясняется увеличением количества электронных слоев и увеличением удаления внешних электронов от ядра.
Энергия ионизации
Удаление электрона из невозбуждённого атома при преобразовании его в положительно заряженный ион — это процесс всегда эндоэнергетический (то есть, проходит при поглощении энергии), поэтому для его осуществления необходимо приложить определенную энергию.
Минимальная энергия, необходимая для отрыва электрона от невозбужденного атома, называется энергией ионизации I :
![]()
где символами Е и E+ обозначены соответственно нейтральный атом и положительно заряженный ион (катион) некоторого элемента, I — энергия ионизации, ē — электрон.
Энергия ионизации измеряется в [кДж / моль] или [эВ / атом]. 1 эВ (электрон-вольт) — это энергия, которую приобретает электрон в ускоряющем электрическом поле с разностью потенциалов 1В; (1эВ = 1,6 · 10-19 Дж), в пересчете на 1 моль это соответствует энергии 96,5кДж / моль. Энергию ионизации можно определить путем бомбардировки атомов электронами, ускоренными в электрическом поле.
От многоэлектронного атома можно оторвать один, два и более электронов. Отрыву каждого электрона соответствует определенное значение энергии ионизации i 1 , i 2 , …, i n , при этом всегда i 1 <I 2 <… <I n , поскольку увеличение количества оторванных электронов способствует росту положительного заряда иона. Внешние электроны отрываются от атома достаточно легко, так как имеют более высокую энергию, чем электроны предыдущего уровня, и их отрыв требует сравнительно незначительных затрат энергии. Но при переходе к внутреннему электронному слою энергия ионизации резко возрастает. Итак, полностью заполненные энергетические уровни проявляют повышенную устойчивость.
Энергия ионизации зависит от величины заряда ядра, расстояния между ядром и внешним электроном, экранирующим эффектом внутренних электронных слоев, электронной конфигурации атома. Вообще можно сказать, что величина энергии ионизации зависит от положения элемента в периодической системе и изменяется как в пределах групп, так и в пределах периодов. Энергия отрыва первого электрона от атома в зависимости от порядкового номера элемента меняется периодически.
Зависимость первого потенциала ионизации I1 атома от порядкового номера Z элемента:
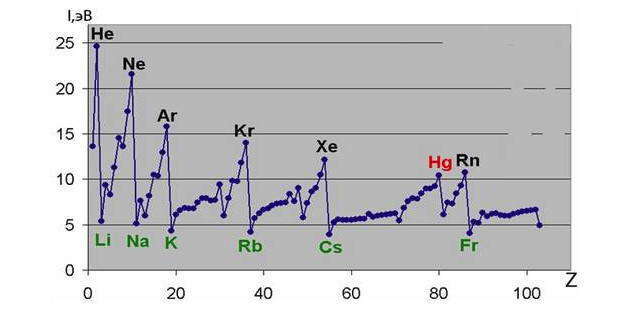
У элементов одного и того же периода при переходе от щелочного металла к благородному газу заряд ядра увеличивается, а радиус атома уменьшается. Поэтому энергия ионизации постепенно увеличивается, а металлические свойства ослабляются. Но общая тенденция к росту энергии ионизации в пределах периода в некоторых случаях нарушается. Так, энергии ионизации атомов Ве выше, чем у В, расположенного за ним; аналогичное явление наблюдается и в третьем периоде при переходе от Мg к Al и от Р к S. При этом повышенные значения наблюдаются или у атомов с полностью застроенным внешним s-подуровнем (Be, Мg), или у атомов с ровно наполовину застроенным р-подуровнем (N, P). Это одно из доказательств положения, согласно которому повышенную энергетическую устойчивость имеют электронные конфигурации с полностью (s2 , p6 , d10 ) и ровно наполовину (р3 , d5 ) застроенными подуровнями.
Энергия ионизации в рядах d-элементов меняется мало. Это объясняется тем, что увеличение заряда ядра компенсируется экранирующих действием электронов, размещенных на внутренних энергетических уровнях.
В рамках подгрупп периодической системы увеличение порядкового номера элемента сопровождается увеличением размера атома. Увеличение заряда ядра в подгруппах меньше влияет на связь внешнего электрона с ядром, чем увеличение размера атома и числа экранирующих электронов. Поэтому в пределах подгрупп s- и р-элементов связь внешнего электрона с ядром уменьшается, что приводит к уменьшению энергии ионизации и усилению металлических свойств. Исключение составляют подгруппы d-элементов, в пределах которых при переходе от 3d- к 5d-элементам энергия ионизации увеличивается.
Величина энергии ионизации может характеризовать металлические свойства элемента: они тем выше, чем меньше значение I.
Сродство к электрону
Некоторые нейтральные атомы могут присоединять электроны — такое свойство называется сродством к электрону. Если при этом выделяется энергия, то образуются устойчивые отрицательно заряженные ионы, а если энергия поглощается, то образуются неустойчивые отрицательно заряженные ионы. Количественной мерой сродства к электрону есть энергия родства. Однако на практике характеризуя энергию сродства к электрону обычно не используют слово «энергия», ограничиваясь упрощенным термином «сродство к электрону».
Сродство к электрону F — это энергетический эффект процесса присоединения электрона к нейтральному атому с превращением его в отрицательно заряженный ион:
![]()
где символами Е и E — обозначены соответственно нейтральный атом и отрицательно заряженный ион (анион) некоторого элемента, F — сродство к электрону, ē — электрон. Измеряется сродство к электрону в [кДж / моль] или [эВ / атом].
Величина энергии сродства к электрону F для атомов элементов имеет периодическую зависимость от заряда ядра атома.
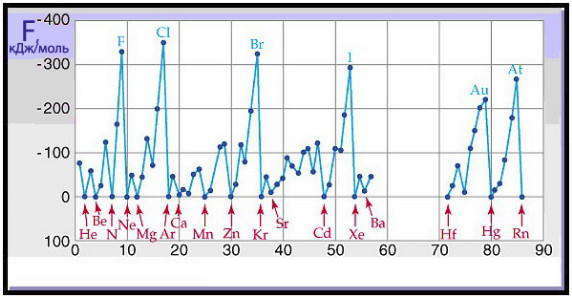
Сродство к электрону зависит от электронной конфигурации атома и его химических свойств. Наибольшее сродство к электрону имеют р-элементы седьмой группы (F, Cl, Br, I), а маленькие и даже отрицательные значения — атомы с конфигурациями s2 (Be, Mg), s2p6 (Ne, Ar) или p3 (N, P).
Сродство к электрону атомов металлов близка к нулю, то есть присоединения электронов к их атомам энергетически невыгодно. Сродство к электрону атомов неметаллов имеет положительное значение, поскольку этот процесс энергетически выгоден.
Присоединение одного электрона к атомам О, S, C и некоторым другим сопровождается выделением энергии. Таким образом, для этих элементов силы притяжения к ядру дополнительного электрона преобладают над силами отталкивания между дополнительным электроном и электронной оболочкой атома. Присоединение дальнейших электронов (двух, трех и более) к атому согласно квантово-механическими расчетами невозможно. Поэтому одноатомные многозарядные анионы (О2 , S2 , N3 ) в свободном состоянии существовать не могут.
Электроотрицательность
Один и тот же атом в зависимости от условий может присоединять электроны, проявляя родство с ними, или отдавать электроны атома другого элемента, у которого сродство к электрону больше.
Электроотрицательность (ЕН или χ) — это обобщенная функция, характеризующая способность атома данного элемента оттягивать на себя электронную плотность по сравнению с атомами других элементов того же соединения.
Термин «электрон» был введен американским химиком Л.Полингом, который составил первую шкалу электроотрицательности. Понятие электроотрицательности позволяет оценить относительную активность элемента и способность его атомов приобретать отрицательный заряд. Очевидно, эта способность зависит от энергии ионизации и сродства к электрону. Существует несколько способов оценочного расчета электроотрицательности. Согласно одному из них электрон атома равен полусумме его первой энергии ионизации и сродства к электрону:
![]()
Следует отметить, что электроотрицательность определенного элемента не является постоянной. На нее влияют различные факторы: валентное состояние элемента, тип соединений, содержания которой он входит и тому подобное. Но это понятие полезное для качественного объяснения свойств элементов и их соединений.
В пределах одного периода с ростом порядкового номера элемента наблюдается тенденция повышения электроотрицательности, а в подгруппах — ее снижение. Наименьшими значениями электроотрицательности характеризуются s-элементы первой группы, а крупнейшими — р-элементы седьмой группы.
