Закон сохранения массы и энергии
Один из фундаментальных и общих законов природы — закон сохранения массы — был открыт М.В.Ломоносовым и Л.Лавуазье независимо друг от друга:
Общая масса веществ, вступающих в химическую реакцию, равна общей массе веществ, образующихся в результате реакции.
Из закона сохранения массы веществ следует важный следствие закона сохранения массы: количество атомов каждого элемента до и после реакции остается постоянным.
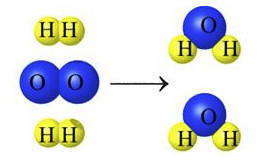
Сам Ломоносов считал, что закон сохранения массы веществ является частью более общего закона природы и может быть распространен на другие формы движения материи. Он утверждал, что тело, которое своим толчком возбуждает другое тело к движению, теряет от своего движения столько же, сколько отдает другому. Согласно гипотезе Ломоносова изменения в природе происходят так, что если к чему-то несколько прибавилось, то это отнимется у чего-то другого.
Эта гипотеза была развита только после открытия второй части универсального закона природы — закона сохранения энергии (Майер, 1842 г.):
Энергия не возникает и не исчезает бесследно, а лишь превращается из одной формы в другую в эквивалентных количествах.
Законы сохранения массы и энергии отражают принцип сохранения материи и движения , сущность которого заключается в современном виде формулируется так:
В изолированной системе сумма масс и энергий является постоянной, то есть суммарные массы и энергии веществ, вступающих в реакцию, равны суммарным массам и энергиям продуктов реакции.
Закон сохранения энергии как философский принцип не выводится из более общих постулатов. С физической точки зрения он является следствием однородности времени, то есть тот факт, что законы природы в течение времени не изменяются.
Энергия — это мера движения и взаимодействия различных видов материи. При любых процессах в изолированной системе энергия не возникает и не уничтожается, она может только переходить из одной формы в другую. Например, энергия химического взаимодействия может превращаться в тепловую энергию излучения.
Закон постоянства состава
Сущность закона постоянства состава (Пруст, 1801 г.) заключается в том, что каждое химическое соединение независимо от способа и условий ее добычи имеет определенный массовый состав.
Соотношение между массами элементов, входящих в состав определенной соединения, являются постоянными и не зависят от способа получения этого соединения.
Этот закон не имеет абсолютного обобщенного характера, поскольку в природе существует два типа соединений — с постоянным и с переменным составом.
Соединения, которые имеют постоянный состав и целочисленное атомное соотношение компонентов, называются Дальтониды .
К ним относятся вещества, которые в обычных условиях находятся в газообразном (СО2 , NH3 , NO, HCl) или жидком (Н2О, С6Н6) состоянии или могут быть легко переведены в них, а также кристаллические вещества с молекулярной структурой (I2 , лед).
Соединения переменного состава, в которых стехиометрические соотношения компонентов не соответствуют целым числам, называются бертоллидами .
Бертоллиды не имеют молекулярной структуры. К ним относится подавляющее большинство кристаллических соединений переходных d- и f- элементов: оксиды, гидриды, нитриды, сульфиды, карбиды и другие бинарные соединения. Следует заметить, что на постоянство состава влияет и изотопный состав, например, в обычной воде Н2О и в тяжелой воде D2О массовые доли кислорода различаются.
Итак, состав химических соединений зависит от типа химической связи, агрегатного состояния веществ, изотопного состава и условий их добычи и может быть как постоянным, так и переменным. Поэтому в настоящее формулировки закона постоянства состава внесены некоторые уточнения:
Если химическое соединение имеет молекулярную структуру, то независимо от условий добычи состав ее остается постоянным. Состав химического соединения, не имеющего молекулярной структуры, может изменяться в определенных пределах в зависимости от условий добычи.
Закон объемных соотношений Гей-Люссака
В химических реакциях с участием газов очень часто наблюдается изменение объема реакционной системы. В отличие от постоянства массы веществ, участвующих в реакции и образуются вследствие нее, при взаимодействии газов объем реакционной системы может увеличиваться, уменьшаться или оставаться неизменным. Соотношение между объемами газов устанавливает закон объемных соотношений Гей-Люссака (1808 г.):
Соотношение объемов газов, вступающих в реакцию и образующихся в результате нее, представляет собой соотношение простых чисел, которые являются кратными стехиометрических коэффициентов, стоящих в уравнении реакции перед формулами соответствующих газов.
Этот закон справедлив только в том случае, когда объемы газов измерены при одинаковых условиях.
Из закона Гей-Люссака следует, что стехиометрические коэффициенты в уравнении реакции являются кратными к объемам газов, которые взаимодействуют и образуются.
С помощью закона объемных соотношений можно рассчитать объемы газов или устанавливать состав исходного газа.
Закон Авогадро
Одним из важнейших газовых законов является закон Авогадро:
В равных объемах различных газов при одинаковых условиях содержится одинаковое количество молекул:
N=const, если P,V,T=const, где NN — количество молекул; P, V, T — давление, объем, температура соответственно.
Но поскольку число молекул в реальных образцах вещества очень велико, то была введена универсальная количественная характеристика, которая описывает численный состояние веществ:
Количество вещества ν (или n ) — это физическая величина, определяемая числом частиц — структурных элементов вещества: молекул, атомов, ионов, ионных ассоциатов и тому подобное.
Единицей ее измерения является [ моль ] — одна из основных единиц системы СИ.
Моль — это количество вещества, содержащее столько же структурных элементов вещества, сколько атомов содержится в изотопе углерода-12 массой 12 · 10-3 кг.
Установлено, что масса одного атома изотопа углерода-12 составляет 19,92 · 10-27 кг. Тогда число атомов N в 12 · 10-3 кг равна:
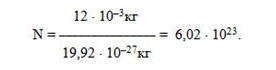
Число, равное 6,02 · 10 23 моль-1, называется постоянной Авогадро.
Постоянная Авогадро обозначается NA и указывает на число частиц — структурных элементов веществе, количество которой составляет 1 моль и поэтому имеет размерность моль -1.
Итак, моль любых структурных элементов — это такое количество вещества, которое содержит 6,02 · 1023 частиц. Например, 1 моль Н2О состоит из 6,02 · 1023 молекул Н2О и содержит 2 моль (или 2 · 6,02 · 1023 ) атомов Н и 1 моль (или 6,02 · 1023 ) атомов В ; 1 моль SO42- содержит 6,02 · 10 23 ионов SO42-, в том числе 1 моль (6,02 · 10 23 ) атомов S и 4 моль (4 * 6,02 · 1023 ) атомов О .
Количество вещества связано с числом частиц N и постоянной Авогадро NA зависимостью ν=N/NA.
Масса одного моля вещества называется молярной массой этого вещества, она обозначается через М .
Молярная масса — это физическая величина, определяемая отношением массы вещества к количеству вещества, которое ей отвечает: M=m/ν.
Единицей измерения молярной массы в системе СИ является [кг / моль], но в химии чаще пользуются внесистемной величиной [г / моль], или [г × моль-1 ].
Молярная масса М связана с относительной молекулярной массой Mr и постоянной Авогадро NA зависимостью M=Mr⋅NA⋅1а.в.м.
Например, относительная молекулярная масса оксида углерода равна Mr(CO2)=12+2⋅16=44, а атомная единица массы составляет 1 а.о.м. = 1,66 × 10-24 г, тогда молярная масса будет М (СО2 ) = 44 × 6,02 · 1023 · 1,66 · 10-24 = 44г / моль.
То есть молярная масса численно равна относительной молекулярной массе, но имеет совсем другой физический смысл: Мr характеризует массу одной молекулы, а М — массу одного моля, то есть 6,02 · 1023 молекул .
Закону Авогадро подлежат все газы независимо от размеров их молекул. Не подлежат ему газы в условиях низких температур и высокого давления, а также вещества в жидком или твердом состоянии. Это объясняется так. Как известно, объем, занимает определенное количество вещества, определяется тремя параметрами: числом составляющих частиц, расстояниями между ними и их размерами. В газах в условиях высоких температур и низкого давления расстояния между молекулами в тысячи раз больше их размеры, поэтому размерами молекул можно пренебречь. В результате объем газа будет оговариваться уже только двумя параметрами: числом молекул и расстояниями между ними. Но при одинаковых условиях (давление и температура) расстояния между молекулами в различных газах одинаковы, поэтому в этом случае равные объемы различных газов содержат одно и то же число молекул.
При низких температурах и под высоким давлением расстояния между молекулами в газах уменьшаются и становятся соизмеримыми с размерами самих молекул, поэтому объем газа зависит от размеров молекул, а газы перестают подлежать закону Авогадро.
Очень часто бывает необходимым знать молярную массу воздуха, которая исчисляется как и молярная масса любой смеси газов с учетом объемной доли φφ каждого газа.
Объемные доли кислорода и азота в воздухе примерно составляют φ(O2)≈0,2 (или 20%), φ(N2)≈0,8 (или 80%). Тогда молярная масса воздуха:
М воздуха =φ(O2)× М (О 2 ) + φ(N2) × М (N2 ) = 0,2 × 32 + 0,8 × 28 = 29г / моль.
1-е следствие закона Авогадро
Один моль любого газа при нормальных условиях (н.у.) занимает объем примерно 22,4 л (0,0224 м3 ).
Эта величина называется молярным объемом , обозначается V M и измеряется в [л / моль] или [м 3 / моль].
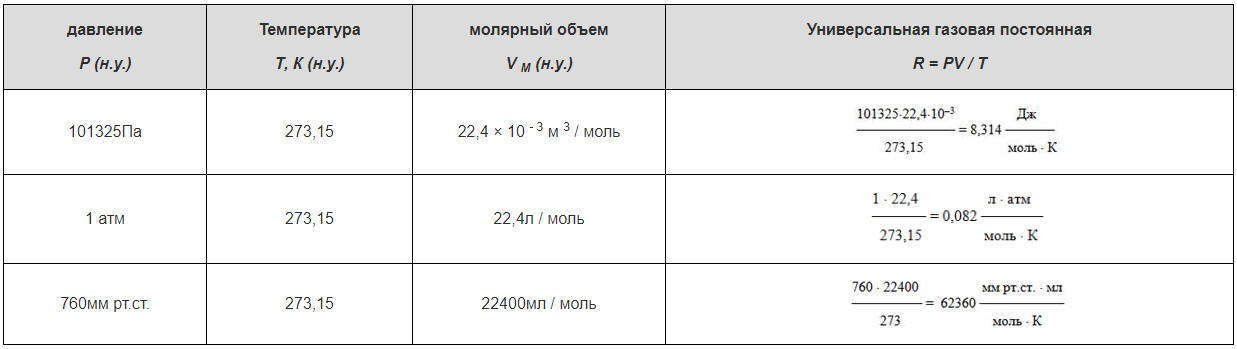
Нормальными условиями считаются: Р = 101325Па (~ 10 5 Па) = 1 атм = 760мм рт.ст., Т = 273,15К или t = 0 0 С.
Молярный объем — это эмпирически установленная величина на основе соотношений:
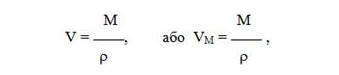
где ρρ — плотность газа, [г / л], или [кг / м 3 ].

Молярный объем в отличие от молярной массы не является постоянной величиной, а зависит от условий (Р, Т), поэтому VM как понятие употребляют обычно для газов при н.у. Молярный объем связан с другими величинами (объемом V , количеством вещества ν , молярной массой М , плотностью ρ, Числом Авогадро NA и количеством частиц N ) соотношениями:
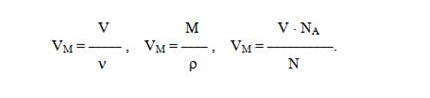
2-е следствие закона Авогадро
Отношение плотности одного газа в плотности другого газа при одинаковых условиях равна отношению их молярных масс М или относительных молекулярных масс Мr .
Эта величина называется плотностью одного газа по другому и обозначается буквой d или D:
ρ1= ρ2⋅ d2ρ1=ρ2⋅d2 (газа 1), ρ2= ρ1/ d2ρ2=ρ1/d2 (газа 1)
М (газа 1) = d 2 (1) × M (газа 2) M (газа 2) = M (газа 1) / d 2 (газа 1).
Относительная плотность d — это величина безразмерная, она показывает, насколько один газ тяжелее другого.
Основные газовые законы
Состояние газа характеризуется его объемом, давлением и температурой. Между этими величинами экспериментально были установлены следующие законы:
- Закон Бойля-Мариотта (изотермический) сокращенно записывается так:
- при Т = const
- Р 1 · V 1 = Р 2 · V 2 , или Р · V = const;
- Закон Гей-Люссака (Изобарный)
- при Р = const
- V 1 / T 1 = V 2 / T 2 , или V / T = const.
- Закон Шарля (Изохорный)
- при V = const
- Р 1 / T 1 = Р 2 / T 2 , или Р / T = const.
Все три закона можно объединить в один универсальный газовый закон , который описывается уравнением Клапейрона:
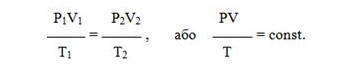
Зависимость для одного моля газа была выведена Менделеевым, поэтому называется уравнением Менделеева-Клапейрона. Оно содержит постоянную величину -универсальную газовую постоянную R.
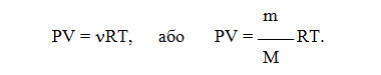
Закон эквивалентов
Из закона постоянства состава следует, что элементы сочетаются друг с другом в определенных количественных соотношениях, для характеристики которых было введено понятие эквивалента и эквивалентной массы (слово эквивалентный в переводе означает равноценный ).
Эквивалентом называется условная или реальная частица вещества, которая может присоединять, замещать, отдавать или взаимодействовать иным образом с одним ионом водорода Н+ или гидроксила ОН— в кислотно-основных (или ионообменных) реакциях или одному электрону в окислительно-восстановительных реакциях.
Например, эквивалентом азотной (азотной) кислоты реальная частица — молекула HNO3 , содержащей один ион Н+ ; эквивалентом ортофосфатной (фосфорной) кислоты — условная частица, соответствует 1/3 молекуле Н3РО4 , в состав которой входят три иона Н+.
Но эквиваленты одного элемента могут быть разными — в зависимости от валентности элемента. Так же сложное соединение может иметь разные эквиваленты, что обусловлено характером ее химического взаимодействия. Например, в реакции нейтрализации ортофосфорная кислота калий гидроксидом
H3PO4 + 2KOH →→ K2HPO4 + 2H2O
только два атома Н кислоты замещаются атомами К (то есть кислота показывает основность 2). Тогда согласно определению, эквивалентом H3PO4 будет условная частица, которая составляет 1 / 2H3PO4 , поскольку на один атом Н приходится именно половина молекулы H3PO4.
Итак, эквивалент — это фактически один вид молекулы, которая соответствует одному атому Н или иона Н+.
Число, показывающее, какая часть молекулы или иной частицы вещества соответствует эквиваленту, называется фактором эквивалентности fЕ .
Эквивалент и фактор эквивалентности: а) fЕ (HCl) = 1; б) fЕ (CaCl2 ) = 1/2; в) fЕ (AlCl3 ) = 1/3; г) fЕ (CCl4 ) = 1/4; д) fЕ (PCl5 ) = 1/5; е) fЕ (SCl6 ) = 1/6. (Эквиваленты соединений окрашенные темным оттенком):
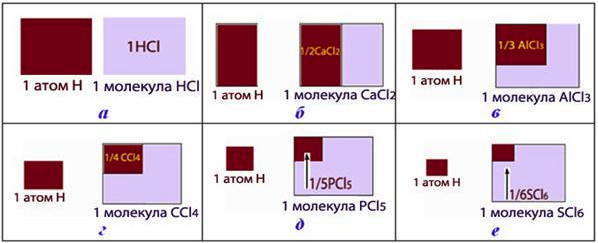
Поскольку эквиваленты элемента и эквиваленты сложного соединения могут быть разными, то как следствие, и фактор эквивалентности тоже будет иметь разные значения, для вычисления которого существуют простые формулы:
| частица | фактор эквивалентности | примеры |
|---|---|---|
| элемент | f Е = 1 / В, где В — валентность элемента | f Е (Р в P2O5 ) = 1/5;
f Е (С в СН4 ) = 1/4 |
| простое соединение | f Е = 1 / ч · В, где В — валентность элемента, ч — число атомов элемента (индекс в химической формуле) | f Е (H2 ) = 1 / (2 * 1) = 1/2;
f Е (O2 ) = 1 / (2 * 2) = 1/4; f Е (Cl2 ) = 1 / (2 * 1) = 1/2; f Е (O3 ) = 1 / (3 · 2) = 1/6 |
| оксид | f Е = 1 / ч · В, где В — валентность элемента, ч — число атомов элемента (индекс в химической формуле) | f Е (Cr2O3 ) = 1 / (2 * 3) = 1/6;
f Е (CrO) = 1 / (1 * 2) = 1/2; f Е (H2O) = 1 / (2 * 1) = 1/2; f Е (P2O5 ) = 1 / (2 * 5) = 1/10 |
| кислота | f Е = 1 / ч (H + ), где ч (H + ) — число атомов H, замещенных в ходе реакции (основность кислоты) | f Е (H2SO4 ) = 1/1 = 1 (если основность в реакции равен 1) или f Е (H2SO4 ) = 1/2 (Если основность равен 2) |
| основа | f Е = 1 / ч (ОН — ), где ч (ОН — ) — число гидроксильных групп ОН — , замещенных в ходе реакции (кислотность основы) | f Е (Cu (OH)2 ) = 1/1 = 1 (Если кислотность в реакции равен 1) или f Е (Cu (OH)2 ) = 1/2 (Если кислотность в реакции равен 2) |
| соль | f Е = 1 / ч (Me) · B (Me) = 1 / ч (An) · В (An), где ч (Ме) — число атомов металла, замещенных в ходе реакции, B (Me) — валентность металла, ч (An) — количество замещенных кислотных остатков, · В (An) — валентность кислотного остатка (или его заряд по абсолютной величине) | F Е (Cr2 (SO4 )3 ) = 1 / (2 * 3) = 1/6 (расчет по металлу)
или f Е (Cr2 (SO4 )3 ) = 1 / (3 * 2) = 1/6 (расчет по кислотному остатка) |
| Ион | f Е = 1 / | z |, где | z | — заряд иона по абсолютной величине | f E (SO4 2- ) = 1/2;
f E (TiO2 2 + ) = 1/2 |
| Частица в окислительно-восстановительной реакции | f Е = 1 / ч (ē), где ч (ē) — число электронов, участвующих в процессе восстановления или окисления частицы | Восстановление: Fe2+ + 2ē →→ Fe0 f E (Fe2+ ) = 1/2;
окисление: CrO4 2- + 8H + + 3ē →→ Cr 3+ + 4H2O f E (CrO4 2 — ) = 1/3 |
Как частица эквивалент характеризуется количеством вещества nэкв и молярной массой эквивалента mэкв , которую чаще для сокращения называют просто эквивалентной массой.
Эквивалентная масса элемента — это масса одного моль эквивалентов, равная отношению молярной массы элемента к его валентности в соединении (или произведения фактора эквивалентности на молярную массу элемента): mэкв.элемента = f E · Мэлемента .
Если хоть одно вещество находится в газообразном состоянии, то удобнее использовать понятие молярный объем эквивалента (или просто — эквивалентный объем ), который рассчитывают по формуле
- Vэкв.газа = V М / ч · В,
- где V М — молярный объем газа (V М = 22,4л / моль (н.у.), ч — количество атомов элемента, В — валентность.
К примеру:
V экв (Н 2 ) = 22,4 / 2 · 1 = 11,2л / моль,
V экв (О 2 ) = 22,4 / 2 * 2 = 5,6л / моль,
V экв (NН 3 ) = 22,4 / 1 * 3 = 7,5л / моль,
V экв (СО 2 ) = 22,4 / 1 * 4 = 5,6л / моль.
Количество эквивалентов nэкв — это число эквивалентов, определяется отношением массы вещества к молярной массы эквивалента или отношением объема газа к его эквивалентному объему:
- nэкв = mвещества / m экв
- nэкв = Vгаза / Vэкв.газа
Молярная масса эквивалента mэкв (эквивалентная масса) имеет размерность [г / моль], молярный объем эквивалента Vэкв.газа — [л / моль], а количество эквивалентов — [моль], (иногда [моль-экв]).
Моль эквивалентов соединения — это такое его количество, которое взаимодействует без остатка с 1 моль эквивалентов атомов водорода или в общем случае — с 1 моль эквивалентов любой вещества.
Понятие количества эквивалентов и эквивалентных масс распространяется и на сложные вещества. Для определения эквивалентной массы сложного состава используются простейшие правила.
Например, эквивалентные массы ионов VO3+ и SO4 2- равны:
mэкв (VO3+ ) = 68 / | +3 | = 22,7г / моль, mэкв (SO4 2- ) = 96 / | -2 | = 48г / моль;
- Эквивалентная масса оксида равна отношению его молярной массы М к произведению валентности элемента В на число атомов элемента.
- Эквивалентная масса кислоты равна отношению ее молярной массы М к основности — количества атомов Н, способных замещаться атомами металла.
- Эквивалентная масса основы равна отношению ее молярной массы М к кислотности — количества гидроксильных групп ОН, которые замещаются на кислотный остаток.
- Эквивалентная масса соли равна отношению ее молярной массы М к произведению валентности В металла на количество его атомов.
- Эквивалентная масса иона равна отношению его молярной массы М к абсолютной величине заряда Z.
- Эквивалентная масса бинарного соединения любого элемента с водородом равна отношению молярной массы этого соединения к валентности элемента.
- Эквивалентная масса сложного вещества равна сумме эквивалентных масс его составных частей.
Например, эквивалентные массы представителей различных классов неорганических соединений:
m экв. оксида = m экв.элемента + m экв. кислорода ,
m экв (Na 2 O) = m экв (Na) + m экв (O) = 23 + 16/2 = 31г / моль.
m экв. основы = m экв (Me) + m экв (ОН — ),
m экв (Ва (ОН) 2 ) = m экв (Ва 2+ ) + m экв (ОН — ) = 137/2 + 17 = 85,5г / моль.
M экв.кислоты = m экв (Н + ) + m экв.кислотного остатка ,
M экв (H 2 SO 4 ) = m экв (H + ) + m экв (SO 4 2 — ) = 1 + 96/2 = 49г / моль.
M экв.соли = m экв (Me) + m экв.кислотного остатка ,
m экв (К 2 СО 3 ) = m экв (К + ) + m экв (СО 3 2 — ) = 39 + 60/2 = 69г / моль.
Закон эквивалентов был экспериментально установлен Рихтером (1797 р.) И окончательно сформулирован Дальтоном (1803р.):
Химические соединения реагируют между собой в эквивалентных соотношениях.
Из этого следует, что для двух любых веществ одной химической реакции (исходных реагентов или продуктов реакции) закон эквивалентов можно выразить так:
- n экв1 = n экв2
Однако при практических расчетах иногда удобнее пользоваться другой формулировкой закона эквивалентов: массы веществ (объемы газов), взаимодействующих между собой, пропорциональны их эквивалентным массам (объемам газов).
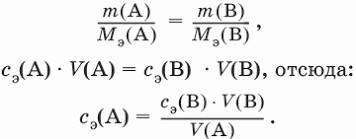
И в заключение приведем основные законы химии, сведенные в таблицу:

