 В окружающем нас мире постоянно проходят химические реакции — перевариваем ли мы пищу, печем ли пироги, ездим ли на машинах. В ходе химической реакции атомы веществ (реагентов) перегруппировываются, образуя новые вещества (продукты реакции). Результат реакции зависит от элементов, из которых состоят реагенты. При ударе молнии азот воздуха реагирует с кислородом, образуя диоксид азота.
В окружающем нас мире постоянно проходят химические реакции — перевариваем ли мы пищу, печем ли пироги, ездим ли на машинах. В ходе химической реакции атомы веществ (реагентов) перегруппировываются, образуя новые вещества (продукты реакции). Результат реакции зависит от элементов, из которых состоят реагенты. При ударе молнии азот воздуха реагирует с кислородом, образуя диоксид азота.
Как проходят реакции
В ходе химической реакции связи между атомами веществ разрываются и атомы образуют связи с новыми партнерами. Ниже показано, как вода и углекислый газ образуют угольную кислоту. Молекула воды (Н20) состоит из двух атомов водорода и одного атома кислорода. Молекула углекислого газа (СО2) состоит из двух атомов кислорода и связанного с ними атома углерода. Связи между атомами в молекулах рвутся, и возникают другие связи. Так образуется молекула угольной кислоты: H2O + CO2 = H2CO3.
Для разрушения связей и возникновения новых требуется энергия, поэтому любая химическая реакция сопровождается энергетическим обменом с окружающей средой. Как правило, выделяется или поглощается тепловая энергия, но в некоторых реакциях участвует свет. Если при реакции выделяется тепло, то реакция называется экзотермической. При эндотермической реакции тепло поглощается. У глубоководных рыб есть особые клетки, в которых происходят реакции, в ходе которых излучается свет. При физических упражнениях в клетках тепла происходят реакции с выделением, т.е. экзотермические реакции.
Многие химические реакции не могут начаться без подвода определенного количества энергии, как правило, тепловой. Тепло заставляет молекулы двигаться быстрее, они сталкиваются друг с другом и вступают в реакцию. Минимальная энергия, необходимая для начала реакции, называется энергией активации. Трение спички о коробок вызывает химическую реакцию, приводящую к возгоранию спички.
Типы реакций
Ниже представлены примеры химических реакций, проходящих в природе и проводимых в лаборатории:
1. Если поместить железный гвоздь в раствор сульфата меди, железо вытеснит медь из раствора и займет ее место, а медь выделится на поверхности гвоздя. Эта реакция — пример вытеснения активным элементом (железом) менее активного (меди).
2. Карстовые пещеры, сталактиты и сталагмиты образуются в результате реакции карбоната кальция, входящего в состав породы, и дождевой воды, содержащей растворенный диоксид углерода.
 3. Внутри батареек есть вещества (как правило, цинк, хлорид аммония и диоксид марганца), при реакции которых возникает электрический ток.
3. Внутри батареек есть вещества (как правило, цинк, хлорид аммония и диоксид марганца), при реакции которых возникает электрический ток.
4. Когда мы перевариваем пищу, в нашем организме происходит множество разных реакций. В ходе их пища разлагается на более простые вещества, которые усваивает организм.
5. Глубоководные рыбы производят свет благодаря проходящим в их клетках реакциям, потому что на больших глубинах очень темно.
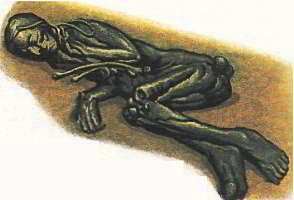 6. Органическая материя разлагается и гниет под воздействием бактерий. Этот человек жил 2000 лет назад, но тело его сохранилось, тик как в слое жидкой грязи, где он лежал, не было воздуха и бактерии не могли там существовать.
6. Органическая материя разлагается и гниет под воздействием бактерий. Этот человек жил 2000 лет назад, но тело его сохранилось, тик как в слое жидкой грязи, где он лежал, не было воздуха и бактерии не могли там существовать.
7. Известняк (карбонат кальция) при нагревании распадается на оксид кальция (известь) и углекислый газ. Это реакция термического разложения.
8. Горение, или сгорание, — это химическая реакции. Когда древесина горит, это означает, что она соединяется с кислородом воздуха. Продукты реакции — углекислый газ, вода и уголь или пепел.
9. Находящиеся в головке спички химикаты реагируют с красным фосфором, нанесенным на коробку, и это приводит к возгоранию.
10. Растения производят питательные вещества в ходе фотосинтеза. Это эндотермическая реакция, использующая энергию солнечного света.
11. Ржавение — форма коррозии. Коррозия — это химическая реакция металла с кислородом воздуха.
Закон сохранения массы
В ходе химических реакций вещество не создается и не уничтожается. В этом и состоит закон сохранения массы. В ходе реакции соединения железа с серой между атомами устанавливаются новые связи. После реакции число атомов не изменилось.
Химические уравнения
Реакция записываются в форме уравнений. В уравнении 2H2 (r) + O2 (r) = 2H2O (ж) помещаются химические формулы веществ, вступивших в реакцию (реагентов), справа — формулы образовавшихся веществ (продуктов реакции). Это уравнение показывает реакцию кислорода и водорода с образованием воды. В обеих сторонах уравнения содержится одинаковое количество атомов. Между реагентами и продуктами ставится стрелка или знак равенства. Если присутствует катализатор, он обозначается над стрелкой. В уравнении также особыми символами может быть указано агрегатное состояние веществ — газ, жидкость, твердое вещество, растворенное вещество (см. статью «Твердые тела, жидкости и газы«). По закону сохранения массы обе части уравнения должны содержать одно и то же число атомов.
Скорость реакции
Некоторые химические реакции, например ржавение, протекают долго и медленно. Другие, такие, как взрыв пороха, проходят практически мгновенно.  Известняк медленно разъедается в ходе реакции с растворенной в дождевой воде угольной кислотой. Скорость реакции зависит от химической активности веществ; более активные элементы реагируют быстрее, чем менее активные. В ходе реакции атомы должны вступить в контакт друг с другом, чтобы образовать новые связи, поэтому газы и жидкости, молекулы которых свободно движутся, более активны, чем твердые вещества.
Известняк медленно разъедается в ходе реакции с растворенной в дождевой воде угольной кислотой. Скорость реакции зависит от химической активности веществ; более активные элементы реагируют быстрее, чем менее активные. В ходе реакции атомы должны вступить в контакт друг с другом, чтобы образовать новые связи, поэтому газы и жидкости, молекулы которых свободно движутся, более активны, чем твердые вещества.
При нагревании энергия частиц вещества увеличивается. Многие частицы приобретают энергию больше минимально необходимой для начала реакции. Только те молекулы твердого вещества, что находятся на поверхности, в состоянии вступать в реакции с другим веществом. Если раздробить твердое тело на мелкие части, площадь поверхности увеличится, и реакции пойдет быстрее. Химическую реакцию ускоряет и увеличение концентрации вещества. За последние 20 лет количество кислот в дождевой воде увеличилось, и дождь наносит теперь больше ущерба деревьям и каменным сооружениям.
Моль
 В химии количество вещества измеряется в молях. Один моль — это 600 000 миллиардов миллиардов частиц, иначе говоря, 6 х 1023. Это число называется числом Авогадро. Именно столько атомов составляют 12 г углерода — 12. Масса одного моля — того же числа частиц — другого элемента будет иной. Масса моля магния 24 г, так как атомы магния тяжелее атомов углерода.
В химии количество вещества измеряется в молях. Один моль — это 600 000 миллиардов миллиардов частиц, иначе говоря, 6 х 1023. Это число называется числом Авогадро. Именно столько атомов составляют 12 г углерода — 12. Масса одного моля — того же числа частиц — другого элемента будет иной. Масса моля магния 24 г, так как атомы магния тяжелее атомов углерода.
Катализаторы
Катализатор — это вещество, влияющее на скорость химической реакции, но само при этом не изменяющееся. Одни катализаторы ускоряют ход реакции, другие — ингибиторы — замедляют реакцию. Катализаторы, ускоряющие реакции в живых организмах, называются ферментами. Паук впрыскивает в жертву ферменты. Ферменты ускоряют ход реакции и разлагают добычу паука. Действие катализатора основано на том, что он понижает энергию активации, т.е. минимальную энергию, необходимую для начала реакции. С катализатором реакция начинается легче. Катализатор — не какое-то особое вещество; это просто вещество, играющее определенную роль в реакции. Катализаторами часто бывают металлы. Каталитические нейтрализаторы, удаляющие ядовитые вещества из выхлопных газов, содержат два металла-катализатора — платину и родий. В каталитическом нейтрализаторе ядовитый угарный газ и углеводороды в присутствии металлов вступают в реакцию и образуют углекислый газ и воду.
Действие ферментов, как и других катализаторов, избирательно. Каждый фермент способствует только одному типу реакций. Разнообразные ферменты, имеющиеся в пищеварительной системе животных, ускоряют реакции, разлагающие пищу на составные части. Ученые считают, что дыра в озоновом слое атмосферы растет быстрее из-за хлора, действующего как катализатор и реакции разложения озона (О3) на кислород (О2). Хлор поступает в атмосферупри распаде хлорфторуглеродов.
